پردازش تصاویر چشم پزشکی
تلاش ها و پیشرفت های مهمی در عرصه پردازش تصاویر شبکیه به منظور ارائه سیستم هایی اتوماتیک جهت تشخیص بیماریهای مختلف روی آن انجام شده است. چنین سیستم هایی علاوه بر اینکه امکان پردازش تصاویر شبکیه را در حجم زیاد و با حداقل زمان و هزینه فراهم می کنند، از خستگی و ضعف های دیگری که شخص تشخیص دهنده می تواند دچار شود مبرا می باشند.
در پانزده سال اخیر کارهای مختلفی در جهت تحلیل و تشخیص اتوماتیک بیماریهایی از قبیل رتینوپاتی دیابتی1، تخریب ماکولای وابسته به سن2، رتینوپاتی زودرس3 انجام شده است و کار بر روی این تصاویر در جهت معرفی الگوریتمهای جدید با قابلیت اعمال بر روی تصاویر با کیفیت و روشنایی مختلف و رسیدن به حداقل خطا همچنان ادامه دارد. همچنین امروزه با استفاده از تکنیکهای پردازش تصویر و اندازه گیری کمی توپوگرافی رگهای خونی شبکیه4 ، ارتباط بین رگهای ریز ایجاد شده بر روی سطح شبکیه و بیماریهای قلبی مورد مطالعه قرار می گیرد. امکان انتقال تصاویر و ارتباط با نقاط دور5 نیز باعث افزایش استفاده از تکنیکهای پردازش تصویر در تصمیم گیری های بالینی بر روی تصاویر شبکیه افراد مراجعه کننده به مراکز درمانی روستایی شده است که امروزه تحت عنوان“Tele-Ophthalmology” از آن یاد می شود. اخذ تصاویر در فواصل زمانی معین از بیمار و ثبت6 این تصاویر نیز امکان مطالعه بر روند تغییرات الگوها و مراحل مختلف چگونگی پیشرفت بیماری بر روی شبکیه را فراهم می سازد.
کارهای مختلفی که در جهت رسیدن به این اهداف بر روی تصاویر شبکیه انجام می شود به شرح زیر است:
افزایش کنتراست 7 و یکنواخت سازی روشنایی 8 تصاویر شبکیه
تشخیص مکان، محدوده و اندازه دیسک نوری9 (جهت بررسی چگونگی پیشرفت گلوکاما)
تشخیص مکان فووآ 10 و محدوده ماکولا11
استخراج رگهای خونی و آنالیز کمی این رگها از لحاظ قطر و مقدار
تشخیص لکه های قرمز تحت عنوان میکروآنوریزم ها12 و هموریژها13 و کلاس بندی آنها
تشخیص لکه های زرد تحت عنوان اگزودیتها14 و کلاس بندی این الگوها به دو دسته سافت-اگزودیت ها15 و هارد-اگزودیت ها16
همچنین تکنیک جدید تصویر برداری از روی شبکیه 3D-OCT17 و فراهم شدن امکان اخذ اطلاعات و تصاویر با دقت و کیفیت بالا از لایه های مختلف شبکیه باعث شده است تا با کار بر روی این تصاویر، خطای الگوریتم های ارائه شده جهت تشخیص و استخراج اتوماتیک الگوهای مرتبط با بیماریهای شبکیه را کمتر نمود، و روش ها و الگوریتم های نوینی در جهت آنالیز اتوماتیک این تصاویر معرفی کرد.
در این گروه با توجه به عملکرد مطلوب تبدیل چند مقیاسی کرولت در حوزه پردازش تصویر سعی شده است الگو های مربوط به بیماری رتینوپاتی دیابتی (اگزودیت ها، هموریژها، میکروآنوریزم ها) و همچنین مکان و محدوده دیسک نوری و رگهای خونی شبکیه با استفاده از این تبدیل و دیگر روشهای معمول پردازش تصویر از روی تصاویر دیجیتالی رنگی شبکیه استخراج شود. همچنین کار بر روی تصاویرOCT و تشخیص بیماریARMD در حال انجام می باشد. در حال حاضر بالغ بر 200 تصویر رنگی شبکیه از بیماران مختلف تهیه شده است و علاقمندان به تحقیق در این حوزه می توانند با اعضای این گروه تماس حاصل نمایند.
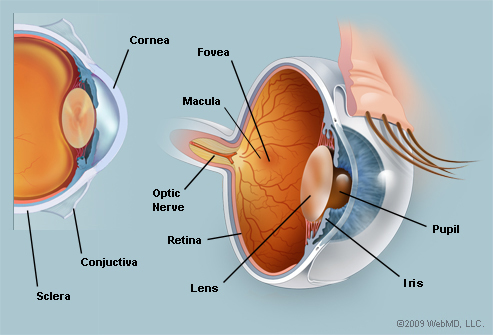
افت شبکیه چشم یک ساختار چند لایه ای است که با ساختاری مرکب از چندین لایه سلولی، بخش خلفی حفره چشم را در بر گرفته (مطابق شکل 1)، مسئول تبدیل انرژی نورانی به سیگنالهای عصبی برای تحلیل نهایی توسط مغز می باشد. لایه های درونی شبکیه همانند شکل 1 شامل موارد زیر می باشند:
_0.png)
.png)
شکل 1– (a) لایه های درونی شبکیه-(b) نمای دو بعدی از چشم. شکل 2 –تغییراتONH در اثر بیماری آب سیاه. (a) ONH نرمال. (b) ONH بعد از بیماری آب سیاه.
نور از میان این لایه های داخلی عبور نموده، بطوریکه سلولهای میله ای[1] و مخروطی[2] درISL وOSL و بدنه این سلولها درONL یک بخش دریافت کننده نور[3] را تشکیل می دهند که وظیفه آن تبدیل سیگنال نوری به سیگنال عصبی می باشد. درOPL، آکسونهای دریافت کننده نور به دندریت های سلولهای دوقطبی و سلولهای افقی که در بین نرونها و به منظور پردازش سیگنال قرار دارند، اتصال می یابند. سلولهای دو قطبی درINL، سیگنال عصبی را از دریافت کننده های نور و سلولهای افقی به آکسون منتقل می نمایند. درIPL آکسونهای دو قطبی به دندریت سلولهای گانگلیون[4] متصل شده و سلولهای گانگلیون درGCL سیگنال عصبی را از طریق عصب بینایی[5] به مغز منتقل می نمایند.
دو مورد از مهمترین بیماریهای مرتبط با شبکیه شامل بیماری آب سیاه[6] و مشکلات شبکیه ناشی از مرض قند[7] می باشد. بیماری آب سیاه دومین علت اصلی نابینایی در جهان به شمار می رود . نشانه این بیماری، گودالی شدن[8] عصب بینایی و از دست رفتن میدان دید می باشد. دهانه عصب بینایی[9] (ONH) بخشی است که عصب بینایی را به شبکیه متصل می نماید و ساختار دو بعدی آن دیسک بینایی[10] نام دارد و تاثیرات بیماری آب سیاه در این محدوده از شبکیه ظاهر می گردد. این تغییرات در شکل 2 نشان داده شده اند.
مشکلات شبکیه ناشی از مرض قند نیز از بیماریهای منجر به نابینایی بوده ولی با تشخیص زود هنگام و معاینات سالیانه می توان از عواقب آن جلوگیری نمود. دلیل اصلی از دست رفتن بینایی در این بیماری، ورم لکه ای دیابتی [11](DME) می باشد که در اثر فرو ریختن سد بین خون و شبکیه بدلیل نشتی مویرگی رخ می دهد (شکل 3). در صورت درگیر شدن مرکز بینایی[12] با ورم، احتمال نابینایی در بیمار بوجود می اید.
بررسی دقیق شبکیه برای تشخیص بیماریهای این اندام، نیازمند نوعی تصویرگیری دقیق از لایه های تشکیل دهنده آن می باشد. روشهای متداول تصویر برداری از شبکیه به شرح زیرند:
افتالمسکوپ که در سال 1851 توسطHermann von Helmholtz معرفی شد.
آنژیوگرافی فلورسنتی که در سال 1961 توسطNovotny وAlvis معرفی شد.
· OCT [13] که در سال 1991 توسطHuang معرفی شد.
روشهای جدید تر مانند اولترسوند و اندازه گیری فلوی خون توسط لیزر.
شکل 4 رنج کاری تصویرگیریOCT را با تکنیک های استاندارد دیگر مقایسه می نماید. این روش تصویرنگاری در ثبت تصاویری مانند اطلاعات ساختاری، جریان خون،پارامتر های کشسانی، تغییرات پلاریزاسیون و محتویات مولکولی توانایی های مناسبی دارد و با استفاده از اصول اندازه گیری طول موج از طریق بررسی تداخل اشعه های نور (اینترفرومتری)[14] می تواند تصاویر دو یا سه بعدی با رزولوشن بالا از مقطع اناتومیکی مورد نظر را بسازد.
.png)
.png)
شکل 4 - مقایسه رنج کاری تصویرگیریOCT با تکنیک های استاندارد. شکل 5 - یک شمای ساده برای سیستمOCT با منبع دارای همدوسی پایین به همراه یک اینترفرومتر.
یک شمای ساده برای سیستمOCT با منبع دارای همدوسی پایین به همراه یک اینترفرومتر در شکل 5 نشان داده شده است.
با تغییر دادن محوری [15] مکان بازوی مرجع، داده مورد نظر در راستای محوری بدست می آید (A scan). در صورتیکه فاصله رفت و برگشتی از رفلکس داده مورد نظر با فاصله رفلکس مرجع برابر باشد، لبه های[16] تداخلی در آشکار ساز دیود نوری حاصل می گردند. دامنه این لبه ها متناسب با مقدار بازتاب پذیری [17] پراکنده ساز [18] می باشد. یک پروفایل دو بعدی (B scan) با حرکت دادن عرضی اشعه و جمع کردن داده های محوری در هر مکان عرضی بدست می آید. تفاوتهای جزئی در لایه های مجاور به صورت تغییرات در شدت دامنه های پراکندگی مشاهده می گردند.
تکنولوژیOCT در دو نوع معمول حوزه زمان و حوزه فوریه مورد استفاده قرار گرفته است. در نوع زمانی، همانطور که در بالا ذکر شد، در صورتیکه فاصله رفت و برگشتی از رفلکس داده مورد نظر با فاصله رفلکس مرجع برابر باشد، لبه های تداخلی در آشکار ساز ظاهر می شوند. ولی در حوزه فوریه بازوی مرجع ثابت باقی می ماند و تفاوت طول مسیر نوری بین نمونه مورد نظر و بازتاب از مرجع توسط فرکانس لبه های تداخلی و بصورت تابعی از طیف منبع کدگذاری می شوند. در سیستم های حوزه فوریه دو نوع شکل بندی وجود دارد: OCT حوزه فرکانس [19] که از یک شبکه از سیم های موازی [20] برای تفرق فضایی [21] طیف از میان آشکاز ساز آرایه ای استفاده می کند. درOCT نوع دامنه جاروبی [22] یک لیزر با باند باریک از میان یک طیف عریض جاروب می شود و طیف را بصورت تابعی از زمان کد می نماید (شکل 6).
صرفنظر از اینکه طیف در حوزه زمان یا در حوزه مکان از میان آشکار ساز آرایه ای نمونه برداری شده باشد، فرکانس لبه های تداخلی بصورت تابعی از طیف بوده مکان پراکندگی را کد می نماید. در نتیجه افزایش فرکانس مشاهده شده متناظر با عدم تطابق بیشتر در طول مسیر نوری می باشد. تبدیل فوریه به عنوان یک ابزار ریاضیاتی متداول برای استخراج محتویات فرکانسی سیگنالها به شمار می رود ولی باید بخاطر داشت که طول موج (بر حسب فاصله) معادل دقیقی از تبدیل فوریه فاصله نمی باشد بلکه به جای طول موج، تعداد موجها (بر حسب عکس فاصله) در این تبدیل فوریه محاسبه می گردد.
.png)
.png)
شکل 6- حالات مختلفOCT حوزه فوریه. شکل 7- لایه بندی اتوماتیک تصاویرOCT
تصاویرOCT اخذ شده به هرکدام از روشهای فوق شامل حجم عظیمی از اطلاعات هستند. در نتیجه تحلیل غیر اتوماتیک و چشمی این داده ها برای چشم پزشک تقریبا ناممکن می باشد. یک عامل موثر در مطرح شدن بحث های مربوط به بخش بندی[23] اتوماتیک این تصاویر، فراهم نمودن یک ابزار کمی مناسب برای کمک به چشم پزشکان در تشخیص و مونیتور نمودن بیماریهای وابسته به چشم می باشد. از آنجاییکه حجم زیادی از اطلاعات در چنین تصاویری نهفته است، اثربخشی چنین نمود اتوماتیکی می تواند در بسیاری از کاربرد ها بوضوح قابل مشاهده باشد. به عنوان مثال، شکل 7 یک نمونه از چنین بخش بندی های اتوماتیکی را بر روی تصاویرOCTنمایش می دهد.
مروری بر روشهای پیش پردازش درتصاویرOCT :
یکی از متداول ترین مشکلات موجود در این تصاویر شامل نویز تقریبا زیاد داده ها می باشد. مقالات متعددی از سال 1991 تاکنون برای پیش پردازش این تصاویر به منظور حذف نویز پیشنهاد شده اند و روشهایی از قبیل فیلتر پایین گذر، فیلتر میانه، روشهای مبتنی بر شبکه های عصبی و روشهای بر پایه موجک در مقالات مورد بررسی قرار گرفته اند. جدول 1 روش های مطرح شده و مقالات مربوطه را بطور خلاصه در بر می گیرد.
جدول 1- روش های مختلف پیش پردازش تصاویرOCT به منظور حذف نویز
Researches | Preprocessing method |
Hee, M.R. | low-pass filtering |
Huang, Y. | 2D lineal smoothing |
George, A., Koozekanani, D, Herzog, A., Shahidi, M.(13),Shrinivasan, VJ., Lee, K. and Boyer, K. | median filter |
Ishikawa, H.,Mayer, M. | mean filter |
M,Baroni | Two 1D filters median filtering along the A-scans Gaussian kernel in the longitudinally direction |
Bagci, A.M. | Directional filtering |
Mishra, A. | adaptive vector-valued kernel function |
Fuller, A.R. | SVM approach |
Quellec , G. | wavelet shrinkage |
Gregori, G., Garvin, M., Cabrera Fernández, D. | non-linear anisotropic filter |
Yazdanpanah, A, Abramoff, M.D. Yang, Q | none |
یکی دیگر از مشکلات مطرح در این تصاویر، ایجاد خطdrift در هنگام تصویرگیری می باشد که روش حل آن استخراج لایهinternal limiting membrane (ILM) و هم تراز کردن کل تصویر بر اساس این منحنی می باشد. هرکدام از روشهای موجود در بخش بندی تصاویرOCT که به آنها اشاره خواهد شد می توانند برای استخراج این منحنی به کار برده شوند. شکل 8 دو نمونه از این نوع تراز را نشان می دهد.
.png)
شکل 8- دو نمونه از تراز تصاویرOCT.
مروری بر روشهای بخش بندی لایه ها درتصاویرOCT :
مهمترین اولویت پردازش در تصاویرOCT بخش بندی این تصاویر در دو یا سه بعد می باشد. با وجود اینکه تکنولوژیOCT از سال 1991 در حال تکامل می باشد، بخش بندی این داده ها تنها در دهه اخیر مطرح شده و به عنوان یکی از مشکل ترین و مورد نیاز ترین گام ها در آنالیز این داده ها قلمداد می گردد و هیچ روش بخش بندی که بتواند برای تمام کاربرد ها مفید واقع گردد تاکنون مطرح نشده است. برای بررسی معنی دار تر، می توان دیدگاه های مختلف در بخش بندی را به 5 دسته تقسیم نمود: روش های قابل اعمال برA-scan، روش های قابل اعمال برB-scan ، روشهای مبتنی بر کانتورهای فعال (معمولا در تصاویر 2 بعدی)، روش های آنالیز بر اساس هوش مصنوعی و روش های مبتنی بر روشهای گراف سه بعدی برای اعمال روی داده های حجمی سه بعدی درOCT. برای بررسی برتری انواع روشها نسبت به یکدیگر میتوان پارامتر های مختلفی را مورد آزمون قرار داد که مدت زمان لازم برای پردازش داده ها یکی از پارامتر های پر اهمیت در این زمینه می باشد. کاهش زمان پردازش موجب قابل استفاده بودن متد در کاربردهای کلنیکی و به صورت همزمان با تصویر گیری[24] می گردد. روشهای مطرح شده تا کنون برای پردازش هر تصویر دو بعدی به 9 تا 120 ثانیه و برای پردازش هر داده سه بعدی به 45 تا 300 ثانیه دست یافته اند. علاوه بر این، خطای مکان یابی نیز در بررسی روش های مختلف از اهمیت بسزایی برخوردار بوده، خطای کمتر موجب اعتبار و قابلیت اطمینان بالای هر روش گردیده، میتواند به عنوان معیاری برای امکان جایگزینی روش اتوماتیک با علامت گذاری دستی باشد. محدوده خطاهای گزارش شده در روشهای قبلی از 36 میکرومتر تا 2.8 میکرومتر متغیر می باشد (البته در محاسبه خطا ها بایستی به زرولوشن تصویرگیری در هر راستا برای تبدیل هر پیکسل به میکرومتر دقت نمود.). محاسبه صحیح تصاویر نشانگر ضخامت لایه ها[25] نیز از جمله نکات مهم در بررسی توانایی روشهای ممکن در این کاربرد به حساب می آید. نکته مهم دیگر در مقایسه روشهای موجود، قدرت این روشها در تفکیک لایه های آناتومیکی مجزا میباشد. بهترین نتیجه گزارش شده در تحقیقات قبلی قادر به تفکیک 10 لایه مجزا می باشند، در صورتیکه تعداد این لایه ها در ساختار نرمال شبکیه 13 عدد میباشند. نهایتا، امکان حذف انحنای ناخواسته تصاویر (هم تراز [26] کردن) که ناشی از حرکات غیر عمدی چشم در حین تصویر برداری می باشد، دارای اهمیت بوده و تمام روشهای موجود، یک مرحله اصلی از الگوریتم ها را به این مرحله اختصاص داده اند.
روش های قابل اعمال برA-scan در ابتدا توسطHee مطرح شدند و تا سال 2005 معمول و فراگیر بودند. این روشها بهیچ وجه از اطلاعات 3 بعدیOCT استفاده نمی کردند و معایبی مانند زمان عملیات بسیار طولانی و صحت پایین در تشخیص لایه ها در آنها غیر قابل اجتناب بود.
روش های قابل اعمال برB-scan توانستند با استفاده از روشهای کاهش نویز در مرحله پیش پردازشی تا حدی نویز دو بعدی را کاهش دهند ولی وابستگی شدید این روشها به کاهش نویز منجر به استفاده از روشهای بسیار پیچیده و زمانبر کاهش نویز مانندanisotropic diffusion گردید که باعث غیر کارآمد شدن این روشها از لحاظ زمان محاسباتی گردید. علاوه بر این، از آنجاییکه این روشها بر اساس شدت روشنایی تصاویر کار می کردند، روش های مورد نظر برای هر تصویر با روشنایی متفاوت باید باز نویسی می شد.
روشهای مبتنی بر کانتورهای فعال در بخش بندی تصاویرOCT برای اولین بار توسطCabrera Fernández مطرح شده، توسط یزدان پناه بهینه گشتند. متاسفانه مدت زمان اجرای الگوریتم ها و خطای دقیق این روشها در هیچ کدام از مقالات ذکر نشده است و در نتیجه مقایسه آنها با روش های دیگر چندان مقدور نمی باشد. با این وجود، این الگوریتم ها بدون شک در مقاومت در برابر نویز و نیز صحت حاصل، بر روش های مبتنی بر شدت روشنایی اعمال شده بهB-scan تفوق می جویند.
روش های آنالیز بر اساس هوش مصنوعی بر اساس ماشین بردار پشتیبان[27] مرتبه ای[28] با قدرت تفکیک چند گانه[29] و یا بر اساس تکنیک های خوشه بندی سی- میانگین فازی[30] پایه ریزی شده اند. روش های مبتنی بر ماشین بردار پشتیبان توانایی پایینی در تشخیص صحیح داشتند (تفاوت 6 پیکسلی در تشخیص منحنی ها و تفاوت 68 درصدی در تشخیص ضخامت ها) و زمان اجرای این الگوریتم ها نسبتا بالا بود ( 2 دقیقه). اما روشهای مبتنی بر خوشه بندی سی- میانگین فازی با خطای 2 پیکسلی و زمان اجرای 45 ثانیه ای توانستند از روش اول پیشی بگیرند. بطور کلی، این دسته از روشها نمی توانند به عنوان دیدگاه استاندارد معرفی گردند چراکه روشهای مبتنی بر گراف توانستند بخوبی از لحاظ زمان محاسبه و دقت تشخیص نسبت به آنها برتری یابند.
روش های مبتنی بر روشهای گراف سه بعدی در مقایسه با تمام دیدگاه های مطرح شده، مناسب ترین روش، برای کاربرد مورد نظر می باشند. زمان پردازش در این روشها به حد 45 ثانیه برای حجم سه بعدی (480×512×128 وکسل) کاهش یافته است و دقت بالایی در حد خطای 8/2 میکرومتر برای بخش بندی سطوح در این روشها گزارش شده است. چنین روش هایی می توانند با استفاده از تکنیک های سه بعدی سازی و حجم سازی[31] یک نمایش مناسب از نتایج بخش بندی را ارائه نمایند. با استفاده از تکنیک های مبتنی بر بافت[32] در آنالیز گراف، این روش ها نسبت به نویز مقاومند[33] و در نتیجه عملیات حذف نویز پیچیده و زمانبر در مرحله پیش پردازش تا حد زیادی غیر ضروری می باشند. همچنین این روشها می توانند 10 لایه را در تصاویرOCT بخش بندی نمایند، در صورتیکه چنین عملکردی برای هیچکدام از الگوریتم های فوق الذکر ممکن نمی باشد. جدول 2 یک جمع بندی بر روی دیدگاه های مطرح شده در بالا را ارائه می نماید و همچنین این روش ها را از لحاظ سیستمOCT مورد استفاده، روش پیش پردازش، محدوده خطا و زمان محاسبات مقایسه می کند.
از آنجاییکه روش های مبتنی بر گراف سه بعدی در بین روشهای فوق دارای اولویت بالاتر می باشند، در این تحقیق بدنبال روشهای جدیدی در حوزه گراف هستیم تا بتواند نقایص موجود در روشهای بخش بندی مطرح شده را برطرف نماید و یک مجموعه جواب بهینه ارائه نمایند. همچنین روشهایی مد نظر می باشند که علاوه بر بخش بندی مناسب داده ها، بتوانند در داده ی بیمار نیز بخوبی عمل کرده قادر به بازشناسی بخشهای آناتومیکی ناشی از بیماری مانند لایه های ملتهب، تجمع مایع میان بافتی و نیز پارگی در لایه ها باشد.
جدول 2- جمع بندی بر روی دیدگاه های موجود در بخش بندی تصاویرOCT
Segmentation Approach | Papers | OCT systems | preprocessing method | Error range | computation time |
A-scan | Hee , Huang , George, Koozekanani Gregori), Herzog, Shahidi, Ishikawa, Shrinivasan | TDOCT(Humphrey 2000, Stratus, OCT3Carl-Zeiss Meditec)/SDOCT(Cirrus HD-OCT) | Low-passfiltering, 2D linear smoothing, median filter,non-linearanisotropicfilter | 20-36 µm | Not reported |
B-scan | Boyer, Baroni, Tan, Bagci | TDOCT (OCT 3000Zees-Humphrey, OCT2 Carl-Zeiss Meditec, Stratus)/ SDOCT (RTVue100 OCT, Optovue, Freemont, CA) | 2D median filter, Gaussian smoothing filtering, bilateral filter | 4.2-5 µm | 9.42seconds on a Pentium, 1.8 GHz processor with1 G-Byte of RAM |
Active contours | Cabrera Fernández , Mishra, Yazdanpanah | TDOCT(Stratus OCT)/ experimental HROCT(high speed)/experimentalFD-OCT | Nonlinear anisotropic diffusion filter, adaptive vector-valued kernel function | Around 3pixels | 5- 84 seconds in Pentium 4CPU, 2.26 GHz |
Artificial intelligence | Fuller , Mayer | experimental 3DOCT, SDOCT (Spectralis) | SVMapproach, 2D mean filter, directional filtering | Around 6 voxels | 45-120 seconds on a 2Ghz Pentium IV on a computer with 3GB of RAM (dual processor3GHz Intel Xeon) |
3D graphs | Garvin, Abràmoff , Lee, Yang, Quellec | TDOCT (StratusOCT)/SDOCT(Cirrus–OCTTopcon3DOCT-1000) | 2D spectral reducing anisotropic diffusion filter, median filtering, wavelets | 2.8 - 6.1 µm | 45- 300 seconds using a Windows XP workstation with a 3.2-GHz Intel Xeon CPU/on a PC with Microsoft Windows XP Professionalx64 edition,Intelcore2 Duo CPU at3.00GHz, 4GBRAM, 16seconds in fast segmentation mode |
برگرفته از پروپوزال دکترای مهندس راحله کافیه، دانشجویPhD دانشکده فناوریهای نوین، دانشگاه علوم پزشکی اصفهان
به منظور کسب اطلاعات بیشتر در این زمینه می توانید از لینک های زیر استفاده نمایید:
Photoreceptor, Ganglion, Optic nerve, Glaucoma, Diabetic retinopathy, Cupping, Optic nerve head, Optic disc, Diabetic macular edema, Visual center, Optical Coherence Tomography, Interferometry, Axial, Fringe, Reflectivity, Scattered, Spectral Domain (SD), Gating, Spatial disperse, Swept Source (SS), Segmentation, Online, Thickness map, Align, Support Vector Machine (SVM), Hierarchical, Multiresolution, Fuzzy C-means clustering, Rendering, Contextual, Robust to noise
Selected Publications:
Z. Amini, H. Rabbani, "Statistical Modeling of Retinal Optical Coherence Tomography", IEEE Transactions on Medical Imaging, vol. 35, no. 6, pp. 1544-1554, 2016.
R Kafieh, H Rabbani, F Hajizadeh, M D. Abramoff, M Sonka, “Thickness mapping of eleven retinal layers segmented using the diffusion maps method in normal eyes”, Journal of Ophthalmology, 2016.
H. Rabbani, R. Kafieh, M. Kazemian Jahromi, et al., “Obtaining Thickness Maps of Corneal Layers Using the Optimal Algorithm for Intracorneal Layer Segmentation,” International Journal of Biomedical Imaging, vol. 2016, Article ID 1420230, 11 pages, 2016.
M. Niknejad, H. Rabbani, M. Babaei-Zadeh, "Image Restoration Using Gaussian Mixture Models With Spatially Constrained Patch Clustering," IEEE Transactions on Image Processing, vol. 24, no. 11, pp. 3624-3636, June 2015.
H. Rabbani, M.J. Allingham, P.S. Mettu, S.W. Cousins, S. Farsiu, "Fully Automatic Segmentation of Fluorescein Leakage in Subjects with Diabetic Macular Edema", Investigative Ophthalmology and Visual Science, vol. 56, no. 3, pp. 1482-1492, 2015.
Z. Amini, H. Rabbani, “Classification of Medical Image Modeling Methods: A Review”, Current Medical Imaging Reviews, 2016.
SH. Hajeb, H. Rabbani, MR. Akhlaghi, "A New Combined Method Based on Curvelet Transform and Morphological Operators for Automatic Detection of Foveal Avascular Zone", Signal, Image & Video Processing (Springer), vol. 8, no. 2, pp. 205-222, Feb. 2014.
R Kafieh, H Rabbani, I Selesnick, "Three Dimensional Data-Driven Multi Scale Atomic Representation on Optical Coherence Tomography," IEEE Transaction on medical Imaging, 2015; 34(5):1042-62.
H Danesh, R Kafieh, H Rabbani, and F Hajizadeh, , "Segmentation of Choroidal Boundary in Enhanced Depth Imaging OCTs Using a Multiresolution Texture Based Modeling in Graph Cuts," Computational and Mathematical Methods in Medicine, vol. 20, p. 1-9, 2014.
H. Rabbani, M. Sonka, M. D. Abramoff, "Optical Coherence Tomography Noise Reduction Using Anisotropic Local Bivariate Gaussian Mixture Prior in 3-D Complex Wavelet Domain", International Journal of Biomedical Imaging, vol. 2013, Article ID 417491, 23 pages.
M Kazemian Jahromi, R Kafieh, H Rabbani, A Mehri Dehnavi, A Peyman, F Hajizadeh, M Ommani, "An Automatic Algorithm for Segmentation of the Boundaries of Corneal Layers in Optical Coherence Tomography Images using Gaussian Mixture Model," Journal of Medical Signals and Sensors, vol. 4, No.3, p. 181-193, 2013.
R Kafieh, H Rabbani, M D. Abramoff, M Sonka, “Intra-Retinal Layer Segmentation of 3D Optical Coherence Tomography Using Coarse Grained Diffusion Map”, Medical Image Analysis, Vol. 17, No. 8, p. 907-928 2013.
R. Kafieh, H. Rabbani, M. D. Abramoff, and M. Sonka, "Curvature correction of retinal OCTs using graph-based geometry detection," Physics in medicine and biology, vol. 58, No, 9, p. 2925-2933, 2013.
R. Kafieh, H. Rabbani, and S. Kermani, "A Review of Algorithms for Segmentation of Optical Coherence Tomography from Retina," Journal of Medical Signals and Sensors, vol. 3, No. 1, P. 45-67, 2013.
.برای دسترسی به طرح های فعال در این موضوع اینجا را کلیک کنید


